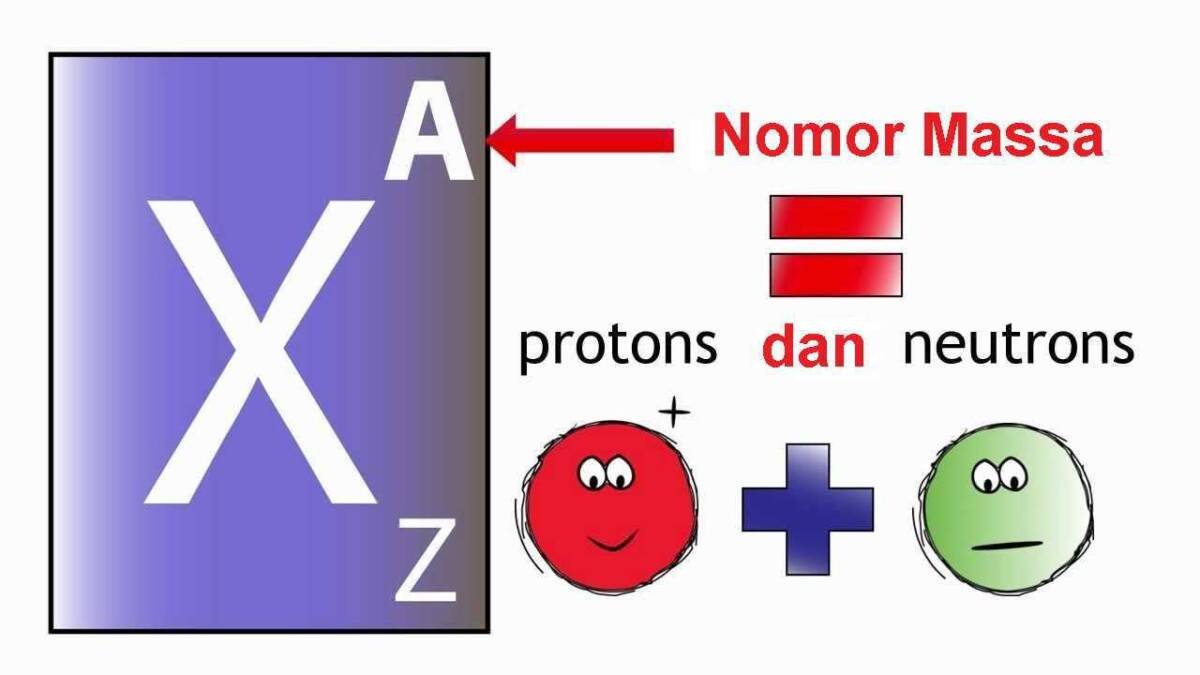
Keadaan elektron valensi suatu unsur dapat kamu gambarkan dengan menggunakan notasi khusus yang disebut struktur Lewis yang dikembangkan oleh G.N. Lewis.
Struktur Lewis suatu unsur digambarkan sebagai simbol atomnya yang dikelilingi oleh sejumlah titik, lingkaran, atau tanda silang yang melambangkan elekron valensinya.
Contohnya, hidrogen, dengan satu elektron valensi, digambarkan sebagai H*. Pembentukan ikatan yang terjadi antar atom dapat lebih mudah kamu pahami dengan menggunakan struktur Lewisnya.
Contoh gambar struktur Lewis
Jika sepasang elektron yang digunakan bersama ditulis sebagai – , maka
Tahap pertama yang harus kamu lakukan untuk menggambar struktur Lewis adalah menentukan atom-atom mana yang saling berikatan. Contohnya, pada CO2, kedua atom oksigen terikat pada atom karbon sebagai pusat molekulnya, sehingga strukturnya tidak mungkin berupa O-O=C.
Sesungguhnya, satu- satunya cara yang pasti untuk menentukan bagaimana atom-atom ini berikatan adalah melalui percobaan. Pada senyawa biner sederhana dan ion-ion poliatom, seperti CO2 dan CO 2-, atom pusat biasanya disebutkan pertama kali.
Contohnya, karbon adalah atom pusat dalam CO2 dan CO 2-; nitrogen adalah atom pusat dalam NH3, NO2, dan NO –; sulfur adalah atom pusat dalam SO3 dan SO 2-.
Tetapi hal ini tidak berlaku untuk H2O dan H2S dan untuk molekul-molekul seperti HClO atau SCN.
Perkiraan yang tepat memang tidak mungkin dibuat dengan cara ini. Setelah susunan atom dalam molekul diketahui, dapat dilanjutkan dengan menempatkan elektron-elektron valensinya.
Cara Menggambar Struktur Lewis
- Hitung jumlah seluruh elektron valensi yang dari seluruh atom dalam molekul atau ion poliatom. Untuk ion poliatom yang bermuatan negatif, tambahkan elektron sesuai besar muatannya. Sebaliknya, untuk ion poliatom yang bermuatan positif, kurangi jumlah elektron sesuai besar muatannya.
- Letakan sepasang elektron antara dua atom yang berikatan.
- Lengkapi konfigurasi oktet atom-atom (ingatlah bahwa kulit valensi atom hidrogen hanya dapat diisi dua elektron)
Konfigurasi oktet atom :

Jika atom pusat masih belum memenuhi aturan oktet, bentuklah ikatan rangkap sehingga aturan ini dipenuhi oleh setiap atom yang berikatan.
Contoh:
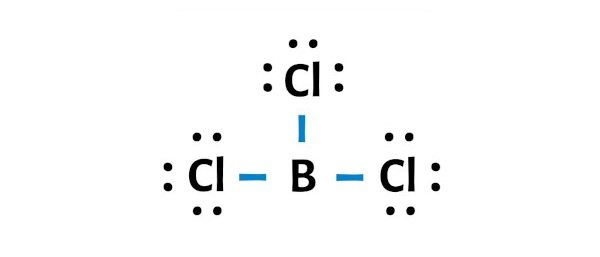
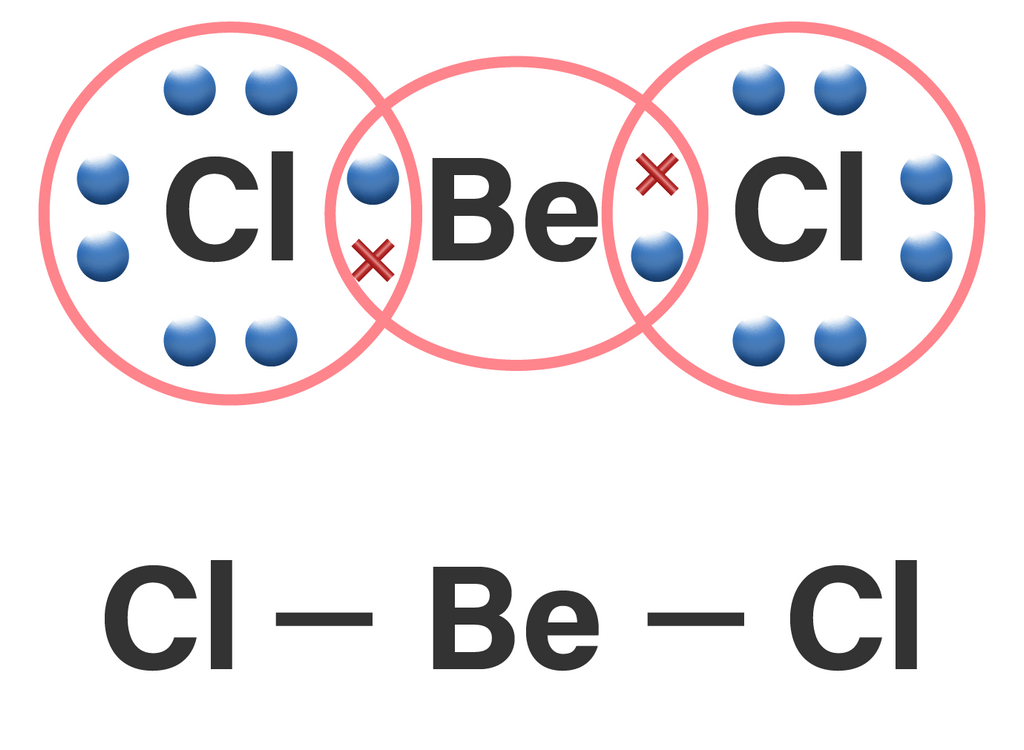
Harus diperhatikan pula bahwa hal ini tidak berlaku untuk senyawa-senyawa yang menyimpang dari aturan oktet, seperti BCl3 dan BeCl2.
Contoh : Struktur Lewis untuk formaldehida, CH2O
Dapat menggambarnya dengan langkah-langkah berikut:
- Tuliskan kerangka molekulnya.
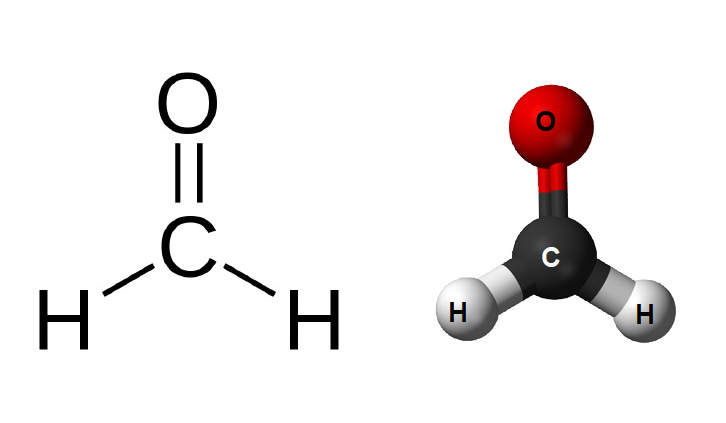
- Hitung jumlah elektron valensi yang ada pada H2CO. Jumlah elektron valensi = 2 + 4 + 6 = 12.
- Letakkan sepasang elektron diantara dua atom yang berikatan.
- Letakkan sisa elektron pada atom ujung yang lebih elektronegatif, yaitu O.
- Sampai tahap ini, atom C belum oktet tetapi sudah tidak ada elektron untuk membuatnya oktet. Struktur oktet dapat dicapai dengan menggeser pasangan elektron bebas pada atom O menjadi elektron ikatan.
Jadi struktur Lewis H2CO adalah :

Kadang-kadang, ada dua struktur Lewis atau lebih yang dapat digambarkan untuk satu senyawa. Contohnya molekul H2SO4. Kita dapat menggambarkan Lambang Lewis untuk senyawa ini sebagai berikut.
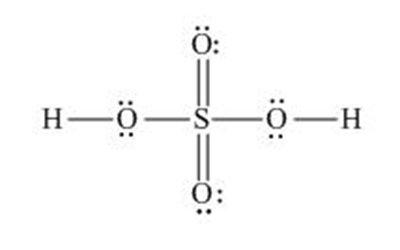
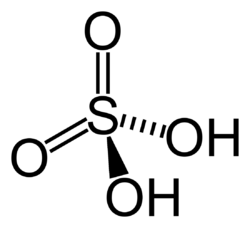
Melalui percobaan, dapat ditentukan struktur mana yang lebih sesuai untuk H2SO4.
Struktur I nampaknya sesuai karena telah mengikuti aturan oktet. Tetapi, hasil percobaan menunjukkan bahwa panjang ikatan antara sulfur dan oksigen yang tidak berikatan dengan hidrogen lebih pendek dibandingkan panjang ikatan yang seharusnya untuk suatu ikatan tunggal S-O.
Ikatan rangkap dalam struktur II memiliki panjang ikatan S-O yang sesuai dengan hasil percobaan. Dengan demikian, struktur yang kedua ini adalah struktur yang lebih sesuai untuk H2SO4.
Muatan Formal adalah
Cara lain untuk menentukan struktur Lewis mana yang lebih sesuai adalah dengan menghitung muatan formalnya. Pada struktur I, sulfur membentuk empat ikatan tunggal dengan oksigen.
Jika elekron-elektron dalam ikatan tersebut dibagi bersama oleh S dan O, maka masing-masing atom memiliki setengah dari pasangan elektron yang digunakan untuk berikatan, atau sebanyak satu elektron untuk setiap ikatan.
Dengan perkataan lain, keempat ikatan ini menunjukkan bahwa ada empat elektron dalam kulit valensi sulfur. Atom sulfur seharusnya memiliki enam elektron valensi. Hal ini berarti bahwa dalam struktur I, sulfur kekurangan dua elektron valensi, atau bermuatan 2+. Muatan ini dinamakan muatan formal.
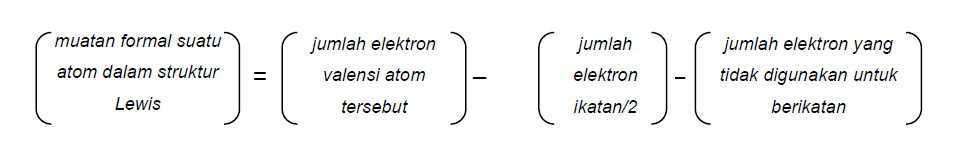
Secara umum, muatan formal suatu atom dalam suatu struktur Lewis dapat dihitung sesuai rumus:
Jadi, untuk struktur Lewis pertama,
Muatan formal sulfur = 6 – 4 – 0 = +2
Untuk Hidrogen Muatan formal = 1- 1 – 0 = 0
Karena oksigen yang tidak berikatan dengan hidrogen, maka Muatan formal
= 6 – 1 – 6 = -1
Muatan formal oksigen yang berikatan dengan hidrogen
= 6 – 2 – 4 = 0
Untuk struktur Lewis kedua,
Muatan formal sulfur = 6 – 6 – 0 = 0
Untuk hidrogen = 1- 1 – 0 = 0
Karena oksigen yang tidak berikatan dengan hidrogen. Maka Muatan formal
= 6 – 2 – 4 = 0
Untuk Muatan formal oksigen yang juga berikatan dengan hidrogen
= 6 – 2 – 4 = 0
Perhatikan bahwa jumlah total muatan formal H2SO4 adalah nol sesuai dengan kenyataan bahwa molekul ini netral. Suatu ion poliatom, jumlah muatan formal atom-atomnya harus sama dengan muatan ionnya.
Untuk menentukan Lambang Lewis mana yang lebih sesuai, ada aturan yang dapat kita ikuti. Jika ada beberapa struktur Lewis yang mungkin, struktur yang muatan formal atom- atomnya mendekati nol adalah struktur yang paling stabil dan lebih disukai.
Pada struktur kedua, seluruh atomnya memiliki muatan formal nol. Dengan demikian, struktur inilah yang lebih disukai.
Simpulan:
- Kegunaan Struktur Lewis adalah untuk mengambarkan pasangan elektron dari atom yang berikatan. Kadang kala dalam membuat struktur Lewis kamu temukan beberapa struktur yang mungkin, untuk menentukan struktur mana yang lebih disukai dapat digunakan konsep muatan formal.



![Download Modul Ajar Matematika Kelas 1 Semester 1 dan 2 Kurikulum Merdeka [gurusekali]](https://jalanguru.com/wp-content/uploads/2023/01/Download-Modul-Ajar-Matematika-Kelas-1-Semester-1-dan-2-Kurikulum-Merdeka-gurusekali-e1759648826168-150x150.jpg)