- Bentuk-bentuk Molekul berdasarkan teori VSEPR
- Teori domain elektron
- Bentuk Molekul dengan Dua Pasangan Elektron atau Dua Domain Elektron di sekitar Atom Pusat
- Bentuk Molekul dengan Tiga Pasangan Elektron atau tiga domain elektron di sekitar Atom Pusat
- Molekul dengan Empat Pasangan Elektron atau empat domain di sekitar Atom Pusat
- Bentuk Molekul dengan lima Pasangan Elektron atau lima domain di sekitar Atom Pusat
- Molekul dengan Enam Pasangan Elektron atau enam domain di sekitar Atom Pusat
- Gaya Antar Molekul
Molekul-molekul senyawa memiliki bentuk molekul atau geometri molekul tertentu. Bentuk ini dapat mempengaruhi terjadinya suatu proses atau reaksi kimia juga menyebabkan perbedaan sifat-sifat dari berbagai molekul. Bentuk molekul dapat dijelaskan melalui teori Tolakan Pasangan Elektron Kulit Valensi maupun teori Hibridisasi.
Bentuk-bentuk Molekul berdasarkan teori VSEPR
Bentuk molekul menggambarkan susunan dari atom-atom suatu molekul dalam bentuk 3 dimensi. Di dalam suatu molekul terdapat suatu atom yang menjadi pusat dan dikelilingi oleh atom-atom lain yang berikatan baik ikatan tunggal, rangkap dua atau tiga. Sedangkan, struktur lewis molekul memiliki arti lebih kepada gambaran posisi elektron baik pasangan elektron ikatan (PEI) atau pasangan elektron bebas (PEB).
Untuk molekul yang relatif kecil atom pusatnya mengandung dua hingga enam ikatan, bentuknya dapat diramalkan dengan menggunakan teori Tolakan Pasangan Elektron Kulit Valensi atau lebih dikenal dengan teori Valence Shell Electron Pair Repulsion (VSEPR).
Teori tersebut berpendapat bahwa pasangan elektron ikatan dan pasangan elektron bebas yang mengelilingi atom pusat lebih condong berada sejauh mungkin satu sama lainnya karena saling tolak menolak.
Apa itu Teori VSEPR?
Dalam kehidupan sehari-hari, untuk menggambarkan Teori VSEPR dapat kamu lakukan dengan memakai model sederhana yaitu balon-balon yang diikat. Di dalam setiap ikatan balon-balon akan tolak menolak sejauh mungkin. Posisi balon pada masing-masing ikatan adalah seperti gambar berikut.

Jika sudut antara balon dengan balon diukur didapat data sebagai berikut.
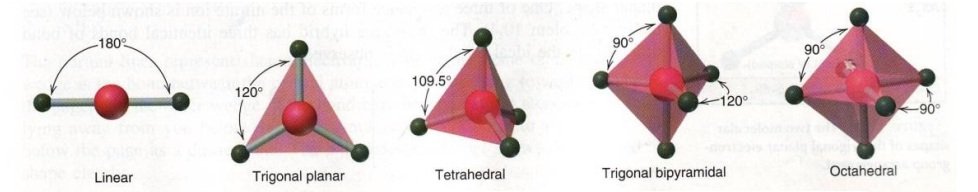
Gambar geometri molekul tersebut merupakan bentuk dari molekul yang memiliki ikatan kovalen tunggal, dan semua pasangan elektron pada atom pusat berupa pasangan elektron ikatan.
Bagaimana bentuk molekul yang mempunyai ikatan kovalen rangkap dua atau tiga?
Untuk menjawab ini digunakan teori domain elektron.
Teori domain elektron merupakan penyempurnaan dari teori VSEPR.
Domain elektron berarti suatu wilayah yang ditempati oleh elektron. Domain elektron dapat pula disebut kelompok elektron. Prinsip teori domain elektron adalah: setiap elektron ikatan (baik itu ikatan tunggal, rangkap, atau rangkap tiga). Hal ini berarti 1 domain dan setiap pasangan elektron bebas dinyatakan sebagai 1 domain. Ikatan rangkap dua dan ikatan rangkap tiga mempunyai daya tolak menolak yang dianggap sama dengan ikatan tunggal.
Untuk menentukan geometri molekul teori VSEPR menggunakan teori domain elektron. Antar domain elektron pada kulit luar atom pusat saling tolak- menolak sehingga domain elektron akan mengatur diri (mengambil formasi) sedemikian rupa, sehingga tolak-menolak di antaranya menjadi minimum.
Melalui teori ini, dapat meramalkan gambar suatu molekul dan ion secara sistematis. Untuk mempelajari ini, molekul-molekul dibagi kedalam dua golongan, yaitu molekul dengan atom pusat yang memiliki pasangan elekton ikatan saja dan molekul yang memiliki pasangan elektron bebas dan ikatan seperti yang ditunjukkan pada gambar berikut.
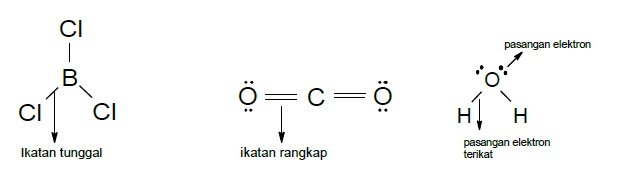
Teori domain elektron
Bentuk-bentuk molekul dituliskan dalam beberapa rumus dengan lambang huruf- huruf, ada beberapa huruf yang melambangkan atom pusat, pasangan elektron ikatan, dan pasangan elektron bebas yaitu:
A = atom pusat
X = jumlah pasangan elektron ikatan
E = jumlah pasangan elektron bebas
Bentuk Molekul dengan Dua Pasangan Elektron atau Dua Domain Elektron di sekitar Atom Pusat
Pada uraian ini gambar struktur molekul hanya diambil dari molekul-molekul yang hanya mengandung dua unsur saja sepeti CH4, H2O, XeF6. dan dilambangkan dengan A dan X. Molekul dengan dua pasangan elektron di sekitar atom pusat tertera pada tabel berikut.
| Struktur Lewis | Klasifikasi | Bentuk Molekul | Keterangan |
BeCl2 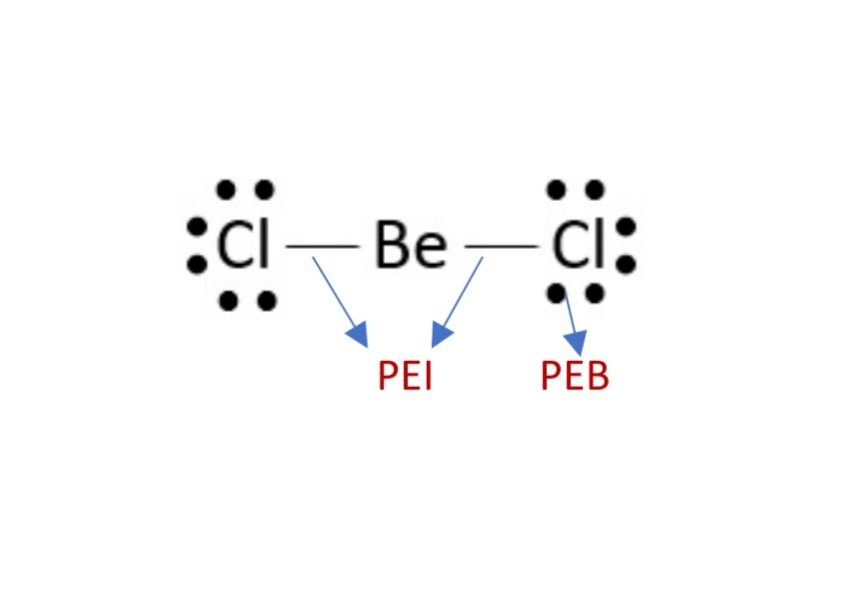 | AX2 |  | Berilium klorida memiliki dua pasangan elektron yang mengelilingi atom pusat dan berada pada ujung-ujung yang berlawanan satu garis lurus agar keduanya berada sejauh mungkin satu sama lain. Sudut Cl-Be-Cl diramalkan 1800,dan molekulnya berbentuk linier |
CO2 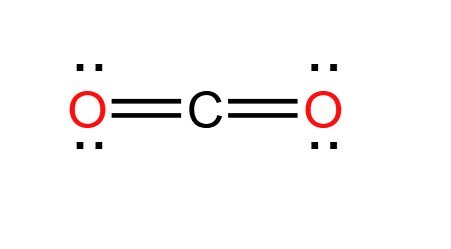 | AX2 | Karbon dioksida memiliki dua kelompok pasangan atau domain elektron yang membentuk ikatan rangkap. Dua kelompok ini tolak menolak sejauh mungkin sehingga CO2 membentuk Linier. |
Dua domain elektron yang berada di sekitar atom pusat akan tolak menolak membentuk susunan elektron linier.
Bentuk Molekul dengan Tiga Pasangan Elektron atau tiga domain elektron di sekitar Atom Pusat
Molekul atau ion dengan tiga domain elektron di sekitar atom pusat tertera pada tabel berikut.
| Struktur Lewis | Klasifikasi | Bentuk Molekul | Keterangan |
BF3 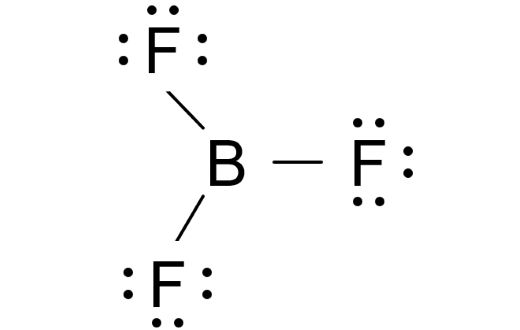 | AX3 | 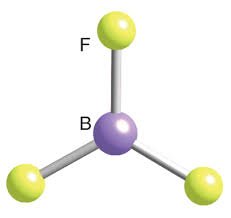 | Boron trifluorida memiliki tiga pasangan elektron. Dalam susunan yang paling stabil, ketiga ikatannya mengarah pada titik sudut segitiga sama sisi. Bentuk molekul BF3 adalah segitiga datar dengan sudut 1200 |
NO –3 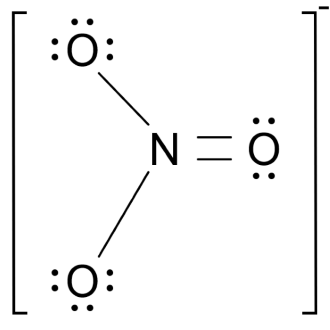 | AX3 | 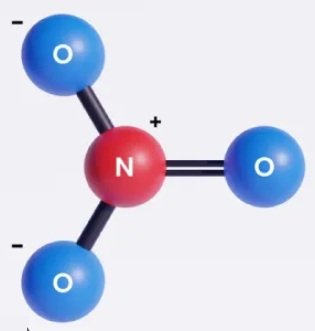 | Ion nitrat memiliki empat pasangan elektron, dua pasang elektron membentuk ikatan tunggal dan dua pasang elektron membentuk ikatan rangkap. Bentuk ion NO – adalah segitiga planar dengan sudut ONO 1200 |
SO2 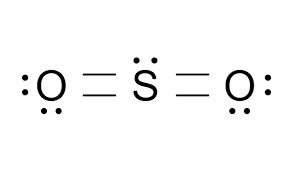 | AX2E | 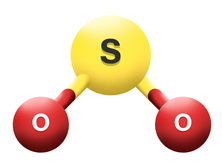 | Belerang dioksida memiliki emptat pasangan elektron pada atom pusat. Dua PEI ikatan rangkap dan satu adalah PEB. Susunan dari domain elektron adalah segitiga datar. Tapi karena salah satunya PEB, maka molekul SO2 memiliki bentuk V atau bentuk ―tekuk‖ dengan sudut OSO lebih kecil dari 1200. |
Tiga pasangan elektron terikat yang berada di sekitar atom pusat akan tolak menolak sehingga terbentuk susunan elektron segitiga planar. Jika ada satu PEB maka geometri molekul berbentuk sudut.
Molekul dengan Empat Pasangan Elektron atau empat domain di sekitar Atom Pusat
Molekul dengan empat pasangan elektron di sekitar atom pusat tertera pada tabel berikut.
| Struktur Lewis | Klasifikasi | Bentuk Molekul | Keterangan |
CH4 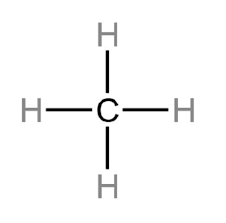 | AX4 | 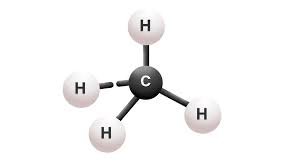 | Metana mengandung empat ikatan kovalen. Atom C terletak pada pusat tetrahedral dan empat atom H terletak pada sudut-sudutnya. Sudut ikatan H-C-H adalah 109,50. |
NH3  | AX3E | 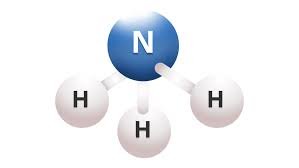 | Amonia mengandung 4 pasang elektron, 3 PEI dan 1 PEB. Struktur ruang elektron membentuk tetrahedral. Oleh karena ada 1 PEB yang daya tolaknya lebih kuat dari PEI maka bentuk molekul NH3 adalah piramida segitiga dengan sudut H-N-H adalah 107,5 º |
H2O 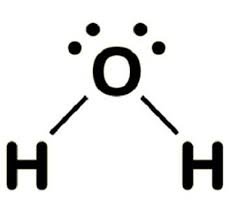 | AX2E2 | 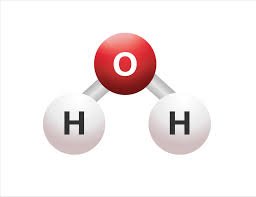 | Air mengandung empat pasangan elektron pada atom pusat O. Dua PEI dan dua PEB. Struktur ruang keempat pasangan elektron adalah tetrahedral. Tapi karena ada 2 PEB, maka molekul H2O memiliki bentuk V atau bentuk tekuk dengan sudut H-O-H adalah 104,5 º |
Empat pasangan elektron terikat yang berada di sekitar atom pusat akan tolak menolak sehingga terbentuk struktur ruang elektron tetrahedral dengan sudut- sudut ikatan yang sama yaitu 109,5 º. Jika ada PEB diantara pasangan elektron tersebut maka sudut-sudut ikatan yang dibentuk oleh PEB akan lebih kecil dari 109,5 º.
Bentuk Molekul dengan lima Pasangan Elektron atau lima domain di sekitar Atom Pusat
Molekul atau ion dengan lima pasangan elektron di sekitar atom pusat tertera pada tabel berikut.
| Rumus Molekul | Klasifikasi | Bentuk Molekul | Keterangan |
PCl5 AsF5 | AX5 | 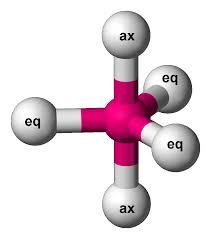 | Molekul yang mengandung lima pasangan elektron yang mengelilingi atom pusat membentuk molektul bipiramida segitiga. Sudut antara dua ikatan ekuatorial adalah 1200, sudut antara ikatan aksial dan ikatan ekuatorial adalah 900 |
SF4XeO2F2 | AX4E | 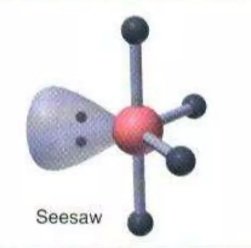 | Molekul yang mengandung lima pasang elektron dengan 4 PEI dan 1 PEB memiliki bentuk molekul Seesaw atau jungkat-jungkit |
ClF3 BrF3 | AX3E2 | 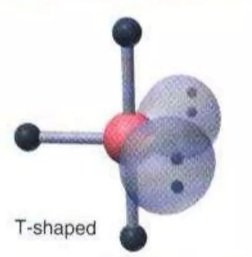 | Molekul yang mengandung lima pasang elektron dengan 3 PEI dan 2 PEB memiliki bentuk molekul T-Shape atau bentuk T |
XeF2 | AX2E3 | 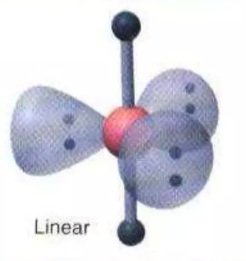  | Molekul yang mengandung lima pasang elektron dengan 3 PEI dan 2 PEB memiliki bentuk molekul Linier |
Lima pasangan elektron yang berada di sekitar atom pusat akan tolak menolak sehingga terbentuk struktur ruang elektron bipiramidal trigonal.
Molekul dengan Enam Pasangan Elektron atau enam domain di sekitar Atom Pusat
Enam pasangan elektron di sekitar atom pusat akan membentuk struktur ruang elektron oktahedral. Contoh molekul tertera pada tabel berikut.
| Struktur Lewis | Klasifikasi VSEPR | Bentuk Molekul | Keterangan |
SF6 | AX6 | 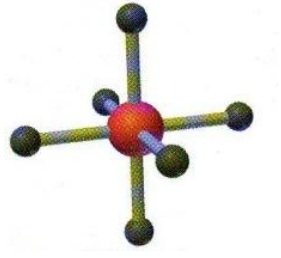 | Molekul yang mengandung enam pasangan elektron yang mengelilingi atom pusat membentuk molektul oktahedral. Semua sudut ikatan adalah 900 |
BrF5 XeOF4 | AX5E | 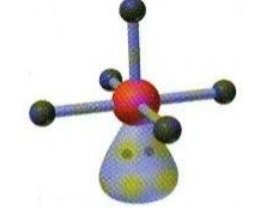 | Molekul yang mengandung enam pasang elektron dengan 5 PEI dan 1 PEB memiliki bentuk molekul piramida segiempat |
XeF4 | AX4E2 | 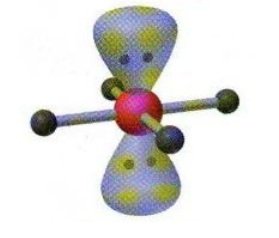 | Molekul yang mengandung enam pasang elektron dengan 4 PEI dan 2 PEB memiliki bentuk molekul segiempat planar |
Enam pasangan elektron yang berada di sekitar atom pusat akan tolak menolak sehingga terbentuk struktur ruang elektron oktahedral.
Gaya Antar Molekul
Dari bentuk-bentuk molekul yang ada pada contoh-contoh ternyata bentuk molekul sangat dipengaruhi oleh jumlah pasangan elektron yang mengelilingi atom pusat baik PEI atau PEB. Dengan kata lain, bentuk molekul akan lebih rumit jika atom pusatnya memiliki pasangan elektron bebas dan pasangan elektron ikatan.
Dalam molekul tersebut terdapat tiga jenis gaya tolak antara pasangan elektron ikatan, antara pasangan elektron bebas, dan antara pasangan elektron ikatan dengan pasangan elektron bebas.
Secara umum, gaya tolak menurun menurut urutan berikut :

Elektron-elektron dalam suatu ikatan ditahan oleh gaya tarik inti kedua atom yang berikatan. Elektron-elektron ini mempunyai distribusi ruang yang lebih kecil dibandingkan pasangan elektron bebas. Pasangan elektron ikatan mengalami tolakan yang lebih kuat dari pasangan elektron bebas tetangganya dan dari pasangan elektron ikatan.
Cara menentukan bentuk molekul dengan teori VSEPR
- Tulis struktur Lewis molekul tersebut.
- Hitung jumlah pasangan elektron di sekitar atom pusat (pasangan elektron ikatan dan pasangan elektron bebas). Perlakukan ikatan rangkap dan ikatan rangkap tiga seolah-olah seperti ikatan tunggal.
- Gunakan Tabel diatas untuk memperkirakan bentuk molekulnya.
Dalam memperkirakan sudut ikatan, perhatikan bahwa pasangan elektron bebas saling tolak-menolak lebih kuat dengan pasangan elektron bebas yang lain atau dengan pasangan elektron ikatan dibandingkan tolak-menolak antara pasangan elektron ikatan lainnya.
Contoh : Menentukan Bentuk Molekul AsH3
- Stuktur Lewis AsH3

- Jumlah pasangan elektron di sekeliling As = 4 pasang ( 3 PEI dan 1 PEB )
- Klasifikasi VSEPR = AX3E
- Bentuk molekul AsH3 adalah segitiga piramida
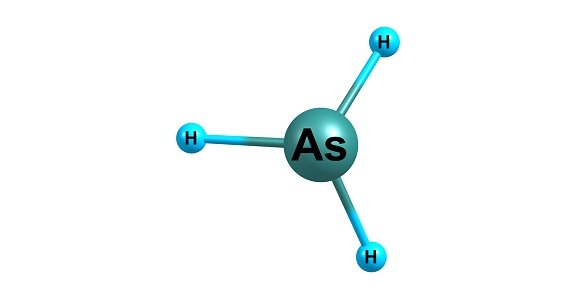
- Sudut H-As-H tidak dapat diramalkan secara tepat, tetapi lebih kecil dari 109,50 karena tolakan antara pasangan elektron ikatan dengan pasangan elektron bebas pada As lebih besar daripada tolakan antara pasangan elektron ikatan.
Simpulan:
Model VSEPR untuk memprediksi geometri molekul didasarkan pada asumsi bahwa pasangan elektron kulit valensi saling tolak dan cenderung mencari posisi sejauh mungkin untuk meminimalkan tolakan.



![Download Modul Ajar Matematika Kelas 1 Semester 1 dan 2 Kurikulum Merdeka [gurusekali]](https://jalanguru.com/wp-content/uploads/2023/01/Download-Modul-Ajar-Matematika-Kelas-1-Semester-1-dan-2-Kurikulum-Merdeka-gurusekali-e1759648826168-150x150.jpg)